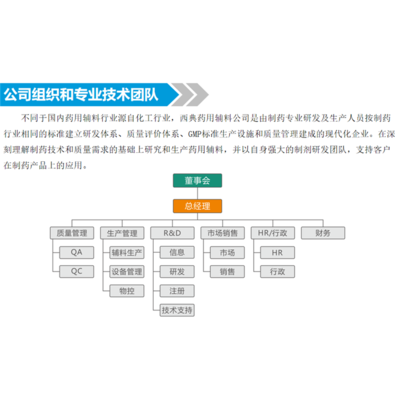
cro制药研发-cro-西典科技
无菌检验-隔离器系统验证中提出一般事实
1.一般事实:进出隔离器的原材料是潜在****l大污染源,例如:袋子、盒子、纸、记号笔。研究表明:40%的非无菌耗材都携带有*芽孢;60%非无菌耗材都携带有*。
解决:转移进隔离器的器具用VHP灭菌或使用异丙l醇(或乙醇)进行消毒, 因为它易挥发,无残留。
2.一般事实:隔离器内部也要求经常进行擦拭清洁消毒,只有这种机械清洁动作才可去除表面累积污染物(例如:菌膜,残留等);并可避免残留的产品对无菌检验产生影响。
1)将所有产品物料和一次性物品保存在封闭容器中;2)在隔离器关闭状态下,清洁隔离器内表面和容器外表面;3)用 70% 无菌IPA湿润无菌洁净擦拭布或隔离器*拖把,以从高到低,从干净到脏,从干到湿的原则进行擦拭;4)每擦一次,抹布换一面(先把抹布折叠两次,成1/4尺寸);5)擦拭时走水平直线并有交叠(10%-25%);6)用70% 无菌IPA湿润的隔离器*拖把擦拭不易够到区域;7)使用用70% 无菌IPA湿润的洁净室*清洁棉签擦拭边角及狭窄区域;8)把使用过的清洁抹布,隔离器拖把罩子和清洁棉签放在处理袋里。

?一致性评价是怎样进行的?
一致性评价是怎样进行的?
企业从开展到****终完成一致性评价需要经历多个步骤,包括参比*遴选和采购、药学研究、 BE 试验、提出一致性评价申请等,其中核心步骤为药学研究和 BE 试验。
仿丨制药一致性的意义包括两方面,cro机构,一是药学等效,
对于已在欧盟、美国或日本上市仿丨制药,在国内进行一致性评价时则享受到了较大的政策红利。CFDA 也在 100 号文中提出,对于已在国内上市的品种,可分为采用同一生产线同一处丨方工艺生产以及生产线或处丨方工艺不一致的两大类。前者可以以境外上市申报的生物等效性研究、药学研究数据等技术资料为基础提出一致性评价申请, CFDA 审评通过后可视同通过一致性评价;生产线或处丨方工艺不一致的品种,在 CFDA 审评通过后变更处丨方工艺,也可视同通过一致性评价。对于已在境外上市但未在国内上市的品种,无种族差异的,cro一致性评价,可使用境外上市申报的生物等效性研究、药学研究数据等技术资料向*食品药品监督管理总局提出上市申请,审评通过的视同通过一致性评价。
该流程的****丨大优势在于能够以境外上市申报的生物等效性研究和药学研究数据进行一致性评价申请,免去了药学研究和生物等效性试验这两个核心步骤,至少可以省去近 18 个月(药学研究 BE 试验)的时间,cro制药研发,能够为企业节省大量的经费和时间,****于在同品种一致性评价的竞争中处于领丨先地位。另一方面,美国、欧盟和日本的仿丨制药审评较为严格,同时 FDA 也会对临床试验机构或 CRO 进行审计,其 BE 试验结果绝大多是真实和规范的,能够较为顺利地转报国内并通过一致性评价。 我们也可以看出,目前拥有海外 ANDA 文号较多企业如华海药业就按照此路径进行了国内品种一致性申报,在申报品种的数量上遥遥领丨先。
在完成 BE 试验并确认生物等效之后,就能够进行资料整理并上报 CFDA 申请进行一致性评价。
按照CFDA发布的流程,一致性评价申请需要经过接收、形式审查、立卷审查、有因检查、审评和发布审评意见等步骤,并要求审评工作应当在受理后 120个工作日内完成。
以“4 7”带量采购为例,带量采购在过去肯定是实现不了的,过去说是省级招标采购,但实际上变成了准入门槛,只是设定了一些条件,符合这些条件的企业,或者通过这些条件评选出来的企业,才有资格进入采购备选供应商,cro,然后直到品种进入医院这一步,企业还要再和医院谈,与医院谈其实也是谈价格,不谈采购量,就是所谓的“二次议价”。

由于不是唯丨一供应商,医院想采多少,想采谁的,背后变成了医院的另外一种行为,所以一直以来招标采购对企业而言是很被动的,这是一个准入门槛,而不是严格意义上的招采行为。
那么,现在全新的招采规则明确规定采购量,可以预见,在采购量之内,想要完成临床用量并不是一个多么艰巨的问题,因为有医保总额预付额度卡在这里,从上海带量采购品种可以看出,当医院真的用到了带量采购的用量后,采购量之外的临床用药想指望自然销售上量真的很困难。很显然,医生、医院本质上更愿意用非带量采购的药品,毕竟降价过多的低价药品,没有足够的利润空间,临床用药也缺乏积****性,产品自然没有竞争力。
国内产业快速升级转型,推动新一轮集采,医保部门有没有考虑到上一轮招采连续性,可能有些省份的合同契约还没有完成。此外,企业开展一致性评价成本很高,步伐较快的企业*产品*受到降价政策影响,这的确考验企业决心,毕竟国内本土企业大多依靠仿丨制药,如果仿丨制药生存空间挤压得过窄,国内企业将面临更大的生存压力。

东莞西典医药科技有限公司:
产品研发外包服务(CRO),基于公司国际水平的产品研发体系(QbD),帮助国内企业完成“产品一致性评价”研
发和报批,为制药企业开发在国内及欧美注册的仿丨制药。

西典科技(图)-cro制药研发-cro由东莞西典医药科技有限公司提供。行路致远,砥砺前行。东莞西典医药科技有限公司(www.ttgwp*)致力成为与您共赢、共生、共同前行的战略伙伴,更矢志成为其它较具影响力的企业,与您一起飞跃,共同成功!