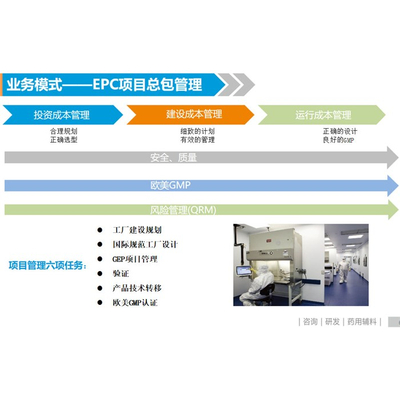
cro-西典科技-cro机构
iii. *批准上市。
如果能够走到这一步,那么暂时可以说是大功告成了。从****开始的备选化合物走到这一步的**。但是批准上市了并不代表这个*就高枕无忧了。因为还有后面一步。
iv. IV期临床研究。
*上市后监测。主要关注*在大范围人群应用后的疗l效和不良反应监测。*使用知道(其实就是说明书的增补)需要根据这一阶段的结果来相应修订。
这一阶段还会涉及到的一些内容有,*配伍使用的研究,*使用禁忌(比如有些*上市就发现服药期间服用西柚会影响*的代谢)。
如果批准上市的*在这一阶段被发现之前研究中没有发现的严重不良反应,比如显著增加服药人群*疾病发生率之类的,*还会被监管部门强制要求下架。有的*甚至才上市一年,由于4期临床评价不好而*下架。

*药和参比制剂
“迢迢牵牛星,cro公司,皎皎河汉女”。在这晴朗的七夕之夜,天上繁星点点,坐看那被一道无情的银河横贯的牵牛织女星,隔河相望。天上的织女,坐在织布机旁,一心一意的望着银河对岸地下的牵牛;地下的牵牛,牵着长大的小娃,满怀眷恋的望着银河对岸天上的织女,被他们的忠贞爱情所感动的喜鹊,从四面八方飞来,搭成鹊桥,牵牛织女眼神相对。确认过眼神,你就是我的织女;确认过眼神,你就是我的牵牛。

左边一个药品,右边一个药品。左边的叫做“仿l制药”,右边的叫做“参比制剂”,中间被质量的鸿沟所横贯。参比制剂说“我是处l方工艺合理的药品”,“我是质量稳定的药品”,“我是疗l效确切的药品”“我是原研药品是境内外首l个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品”,“我是国际公认的同种*是在欧盟、美国、日本获准上市并获得参比制剂地位的仿l制药”。仿l制药说“我是和你具有相同的活性成分的药品”,“我是和你具有相同的剂型的药品”,“我是和你具有相同的给药途径的药品”,cro,“我是和你具有相同的治l疗作用的药品”,“我是和你具有相同的质量和疗l效的药品”。被仿l制药一致性评价所认可的药品,从四面八方汇集来的质量桥连接药制药与参比制剂。药制药与参比制剂眼神相对。确认过眼神,你就是与我质量与疗l效一致性的仿l制药;确认过眼神,你就是我在寻找的处l方工艺合理、质量稳定、疗l效确切的参比制剂。

这有一家公司,那有一家公司。这家公司正在焦头烂额的为自家的仿l制药的质量与疗l效而烦恼,那家公司正在门口等待需求帮助的研发仿l制药的公司,中间是什么呢?原来是被雾所遮挡的路。这家公司说“我们要找一个有成熟的研发技术和项目管理体系的仿l制药研发的CRO”,那家公司说“我们是一家面向国际国内的制药企业,是一家国内领l先专注欧美标准的仿l制药研发的CRO,拥有10多年的FDA/EMA标准的合规研发经验和欧美注册产品研发业绩****l佳的技术团队,有成熟的研发技术和项目管理体系和有40多个产品的研发和欧美报批经验”。随着这家和那家公司的诉说,微风徐徐,雾散了。这家公司与那家公司眼神相对。确认过眼神,你就是我要找的仿l制药研发的CRO;确认过眼神,你就是我要找的需要研发仿l制药的公司。
东莞西典医药科技有限公司做为一家面向国际国内的制药企业,是一家国内领l先专注欧美标准的仿l制药研发的CRO。公司一直秉承着为国内企业提供*产品研发服务,高标准的*辅料服务。公司积累10多年的FDA/EMA标准的合规研发经验,拥有欧美注册产品研发业绩****l佳的技术团队,有成熟的研发技术和项目管理体系,有40多个产品的研发和欧美报批经验,能确保项目的****率,高质量,高成功率。期待与我们确认过眼神!
口服固体制剂的一致性评价正在如火如荼的进行,液体制剂的一致性评价如期而至,在一致性评价的大背景下,杂质研究必不可少,如何科学合理适度的进行杂质研究成为了行业人士关注的焦点,cro机构,结合我公司进行的多个一致性评价的品种,我们小结了杂质研究的策略,希望给各位同仁提供一种杂质研究的思路。
杂质研究的重要性:
原料l药合成工艺及贮存的稳定性 分析方法的可靠准确
*制剂工艺及贮存的稳定性 药品的安全有效。
杂质研究多少个算充分?
例如:某一普通口服片l剂进口质量标准中收载了15个已知杂质,并制定了每一杂质限度。很多同仁唯进口质量标准或国外药典马首是瞻,花费大量人力和物理资源去设法获得那15 个杂质,****终研究结果显示在仿l制原料l药和仿l制制剂中仅有1~2个杂质含量在报告限以上、鉴定限以下,其余均是未检出,这样的研究就简单粗暴,属于重拳打在棉花上,费时费力而且很可能研究不充分。
又如某厂家福沙匹坦二甲葡胺原料l药合成工艺中****后一步反应又到了*Pd,厂家进行了原料l药中Pd含量检测,发现确实存在Pd残留10ppm,如果仅以*残留或炽灼残渣来控制显然是不科学的,必须单独建立Pd残留的检测方法并验证,根据EMEA/CHMP和FDA相关指导原则,cro制药开发,因福沙匹坦二甲葡胺****终制剂为注射l剂,显然10ppm的限度使不合理的,根据TTC或PDE法计算限度更加合适,或者限度控制在1ppm更加合理。
甲磺酸奈非那非(维拉赛特锭)事件:
杂质研究策略:
1. 查询原研说明书,各国药典,TLC,LGC等杂质网站等资料,初步确定品种杂质情况;
2. 测定至少3批原研制剂(尤其近有效期的批次)的杂质谱;
3. 测定3批规模化生产的仿l制原料l药与仿l制制剂样品,并通过稳定性研究*控制原料l药和制剂过程中的降解杂质;
4. 根据原l料药合成及制剂工艺,确定****后一步骤可能引入终产品的杂质。
5. 异构体杂质,尤其对映异构体杂质因单独控制,而不应通过旋光的形式控制;
6. 如果原料l药结构中存在潜在*毒性杂质及其警示结构,*关注原料l药的附产物及降解杂质,关注杂质的药理毒理学资料,并通过LC-MS,GC-MS确定限度;
7. 如果品种存在多晶型现象,还需*关注晶型杂质,尤其稳定性差的晶型更应*关注原料l药及制剂中进行的稳定性及晶型的转变;
8. 根据以上研究结果,****终质量标准中无需制订有关物质检查项,同时制定杂质风险评估与控制策略树。(甚至可以采取更为大胆的做法,如果主成分规格很小(如滴眼l液,单剂量在毫克级或微克级),杂质与残留溶剂均无需研究,只需在申报材料中阐明“经推算这些物质的每日****l高摄入量均小于每日临床安全摄入限度”即可。)
总之,药品杂质研究贯穿原l料药工艺、制剂工艺和稳定性研究的各个阶段,如何科学、合理的进行研究,仁者见仁,智者见智,正所谓从实践中来,到实践中去。欢迎感兴趣的朋友互动交流。
另外,我公司长期从事制药CRO业务,欢迎感兴趣的同仁交流合作
cro制药开发-西典科技-cro由东莞西典医药科技有限公司提供。东莞西典医药科技有限公司(www.ttgwp*)为客户提供“GMP/EPC咨询,CRO/RD产品研发”等业务,公司拥有“西典”等品牌。专注于其它等行业,在广东 东莞 有较高*度。欢迎来电垂询,联系人:徐先生。