境外第二类进口医疗器械*注册资料及办理服务
面议
中国 河南 郑州 中原区
来电请说明在第一枪看到,谢谢!
产品属性
- 服务内容:
- 国内公司注册
- 所在地:
- 河南郑州
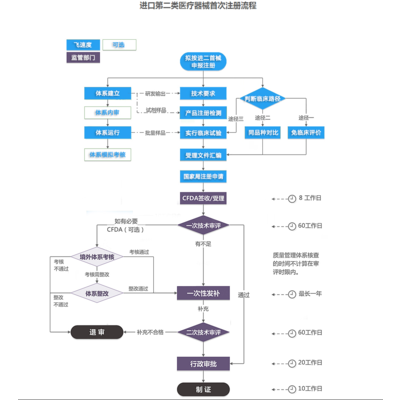
《医疗器械监督管理条例》(*令第650号)第十一条:向我国境内出口第二类医疗器械的境外生产企业,应当由其在我国境内设立的代表机构或者*我国境内的企业法人作为代理人,向*食品药品监督管理部门提交注册申请资料和注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。第二类医疗器械产品注册申请资料中的产品检验报告应当是医疗器械检验机构出具的检验报告;临床评价资料应当包括临床试验报告。
1、申请表
2、证明性文件
3、医疗器械安全有效基本要求清单
4、综述资料
5、研究资料
6、生产制造信息
7、临床评价资料
8、产品风险分析资料
9、产品技术要求
10、产品注册检验报告
11、说明书和标签样稿
12、符合性声明
1、境外申请人注册地或生产地址所在*(地区)医疗器械主管部门出具的允许产品上市销售的证明文件、企业证明文件。
2、境外申请人注册地或者生产地址所在*(地区)未将该产品作为医疗器械管理的,申请人需要提供相关证明文件,包括注册地或者生产地址所在*(地区)准许该产品上市销售的证明文件。
3、境外申请人在中国境内*代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明复印件。
医疗器械按照风险程度实行分类管理,其中第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械,境外医疗器械生产企业需要委托境内代理人在CFDA进行注册。

进口二类医疗器械*注册办理资料
1、申请表
2、证明性文件
3、医疗器械安全有效基本要求清单
4、综述资料
5、研究资料
6、生产制造信息
7、临床评价资料
8、产品风险分析资料
9、产品技术要求
10、产品注册检验报告
11、说明书和标签样稿
12、符合性声明
境外申请人应当提交资料
1、境外申请人注册地或生产地址所在*(地区)医疗器械主管部门出具的允许产品上市销售的证明文件、企业证明文件。
2、境外申请人注册地或者生产地址所在*(地区)未将该产品作为医疗器械管理的,申请人需要提供相关证明文件,包括注册地或者生产地址所在*(地区)准许该产品上市销售的证明文件。
3、境外申请人在中国境内*代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明复印件。
内容声明:第一枪网为第三方互联网信息服务提供者,第一枪(含网站、微信、百家号等)所展示的产品/服务的标题、价格、详情等信息内容系由卖家发布,其真实性、准确性和合法性均由卖家负责,第一枪网概不负责,亦不负任何法律责任。第一枪网提醒您选择产品/服务前注意谨慎核实,如您对产品/服务的标题、价格、详情等任何信息有任何疑问的,请与卖家沟通确认;如您发现有任何违法/侵权信息,请立即向第一枪网举报并提供有效线索至b2b@dyq.cn